Группа исследователей из Германии, Испании и Франции в своей статье в журнале Nature Neuroscience рассказала, как обнаружила свидетельство того, что SARS-CoV-2 атакует эндотелиоциты — выстилающие сосуды клетки — гематоэнцефалического барьера (ГЭБ) головного мозга человека, разделяющего кровеносную и центральную нервную системы. Коронавирус удаляет в них белок NEMO, что ведет к некроптозу — смерти клетки и разрушению сосуда. Как результат, блокируется приток крови в мозг и возникают так называемые «сосуды-призраки» — капилляры, через которые не может течь кровь, что приводит к нарушениям в работе мозга из-за кислородного и глюкозного голодания. В то же время исследователи обнаружили, что клеточную смерть у зараженных коронавирусом модельных животных можно предотвратить — что внушает надежду на подобный результат и для людей.
Как задокументированные клинические случаи, так и работы ученых, исследующих эффект COVID-19 на человека, показывают, что инфекция зачастую приводит к неврологическим проблемам — их выявляют у почти 84 процентов пациентов. Заболевшие часто сообщают о потере вкуса и обоняния, у некоторых из них затуманено сознание. Также отмечены случаи инсультов, припадков и даже психических расстройств. Снижение когнитивных способностей и психические расстройства — одни из наиболее распространенных симптомов постковидного синдрома. Однако до сих пор не было найдено доказательств атаки вирусом клеток в мозге — несмотря на то что геном SARS-CoV-2 был обнаружен в мозге и спинномозговой жидкости некоторых пациентов. Наиболее распространена гипотеза, что основная причина этого — повреждение самих нервов. Однако новая работа европейских ученых показывает, что это не так.
Ученые из Лилльского, Любекского, Геттингенского и Франкфуртского университетов, Института Пастера, Национального института здравоохранения и медицинских исследований Франции и Университета Сантьяго-де-Компостела изучили образцы мозга 40 умерших пациентов, 17 из которых умерли от COVID-19. Проведенная ранее магнитно-резонансная томография мозга показала, что у больных повреждены капилляры мозга, находящиеся в ГЭБ. Поэтому исследователи обратили внимание именно на них.
Окрасив образцы фронтальной коры, ученые выявили у заболевших коронавирусной инфекцией значительный рост числа нитевидных структур диаметром от 0,5 до одного микрометра, в которых не было найдено следов эндотелиальных клеток. На число этих структур не влияло ни то, находился ли пациент на искусственной вентиляции легких, ни то, был ли он в реанимации, — что исключало версию их образования из-за гипоксии. Все свидетельства говорили в пользу того, что причиной образования этих структур является отмирание эндотелиальных клеток. Исследователям удалось воспроизвести результаты на модельных животных — хомяках и мышах. У первых длина нитевидных структур увеличивалась на четвертый день после заражения.
Для того чтобы установить, действительно ли SARS-CoV-2 заражает эндотелиальные клетки, исследователи проанализировали экспрессию генов в полученных у мышей образцах. Выяснилось, что эндотелиоциты действительно экспрессируют ряд рецепторов, связывающихся с вирусом, — в частности, NRP1, играющего важную роль в образовании новых сосудов. При этом экспрессия ACE2 — наиболее известных «ворот» для коронавируса в клетке — не была такой уж значительной.
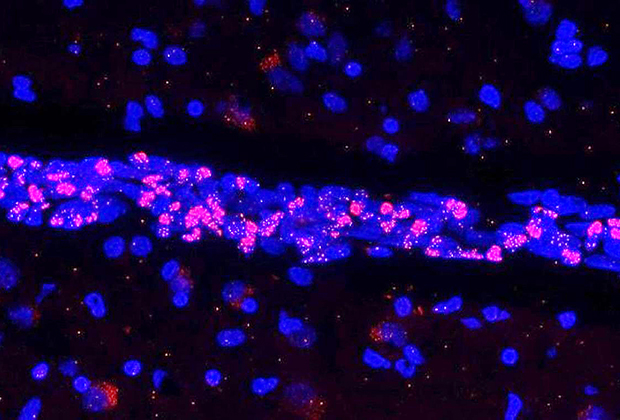
Экспрессия генетического материала SARS-CoV-2 (показан красным) в эндотелиальных клетках
Фото: Vincent Prévot / Inserm
Дальнейшие эксперименты показали, что основная протеаза — «молекулярные ножницы» — коронавируса Mpro (Main Protease) удаляет из эндотелиальных клеток как мышей, так и людей белок NEMO, жизненно необходимый последним для выживания: он активирует сигнальные пути, которые в итоге приводят к иммунному и воспалительному ответу организма. Введение мышам аденоассоциированных вирусных векторов с Мpro увеличило у них число нитевидных структур. У мышей, у которых подавляли экспрессию NEMO, их число также резко увеличивалось — что приводило к смерти эндотелиальных клеток. Эта потеря также влияла и на другие клетки мозга.
Смерть эндотелиоцитов, по словам исследователей, имеет два важных последствия. Во-первых, разрывы в ГЭБ приводят к микрокровотечениям в областях мозга, где крови не должно быть. Кроме того, возникает гипоперфузия некоторых областей мозга — скудное их кровоснабжение, — которая в наиболее тяжелых случаях может иметь фатальные последствия.
Исследователи перепробовали несколько методов, которые позволили бы подавить производство Мpro. Удаление микроглии — макрофагов центральной нервной системы, ответственных за нейровоспалительный ответ, — не смогло остановить образование нитевидных сосудов. Инактивация участвующего в апоптозе Fas-ассоциированного белка с доменом смерти лишь усугубила последствия.
Желаемого эффекта ученым позволила достичь инактивация RIPK3 — фермента, участвующего в процессе апоптоза (клеточной смерти). Пониженное его содержание хоть прямо и не повлияло на капилляры ГЭБ, но тем не менее предотвратило формирование нитевидных структур. Удаление кодирующего фермент гена нормализовало вес и продлило срок жизни у мышей с пониженным содержанием NEMO. Исследователи выяснили, что недостаток фермента повысил плотность ГЭБ у мышей, предотвращая смерть эндотелиальных клеток.
Однако применение ингибиторов RIPK3 неэффективно — так как оно может привести к апоптозу. Ученым удалось найти способ обойти это препятствие — они ингибировали фермент RIPK1, который активировал RIPK3. У мышей, над которыми провели такой эксперимент, не образовывались нитевидные структуры, и нормализовался вес. Клинические испытания ингибиторов RIPK1 уже ведутся, подчеркивают исследователи. Также ученые возлагают надежды на разработку ингибиторов Mpro.
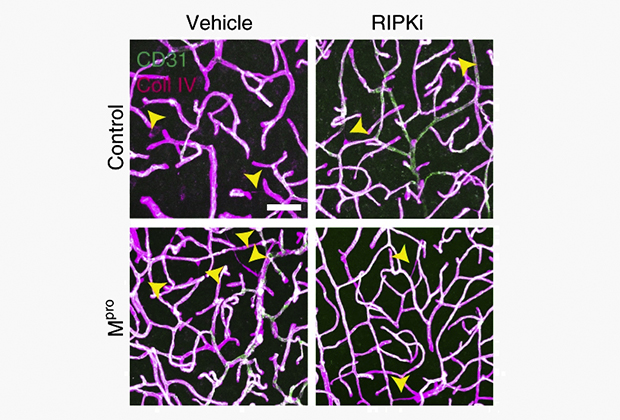
Результат действия ингибитора RIPK (картинки справа) у контрольной группы и у группы с работающей протеазой (внизу)
Изображение: Springer Nature Limited

